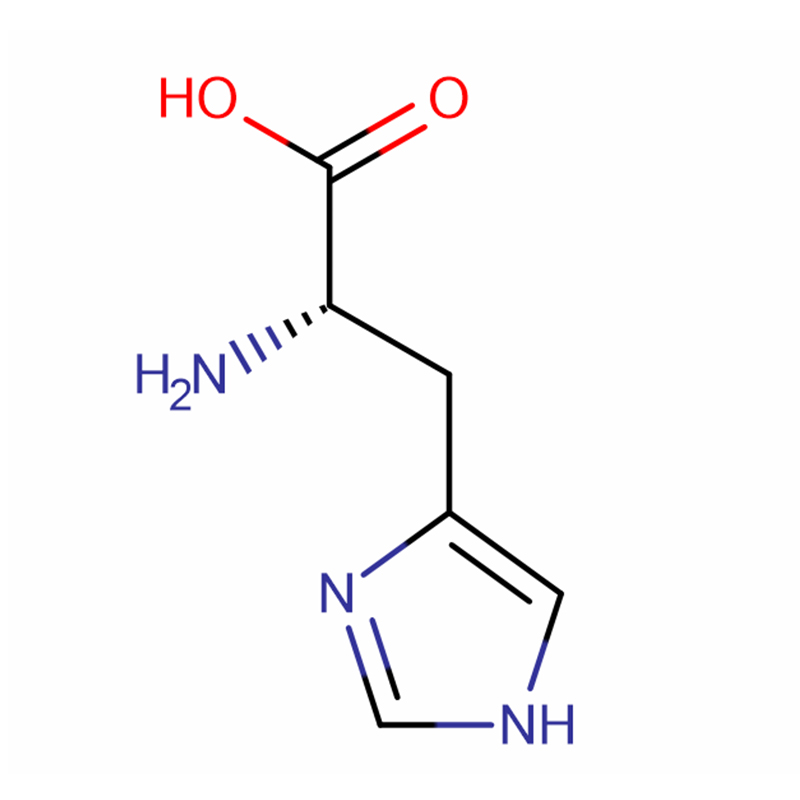
L-Histidin Cas: 71-00-1 98,5% hvide krystaller eller krystallinsk pulver
| Katalognummer | XD90301 |
| produktnavn | L-Histidin |
| CAS | 71-00-1 |
| Molekylær formel | C6H9N3O2 |
| Molekylær vægt | 155,15 |
| Opbevaringsdetaljer | Ambient |
| Harmoniseret tarifkode | 29332990 |
Produkt specifikation
| Assay | 98,5 % min |
| Udseende | Hvide krystaller eller krystallinsk pulver |
| karakter | USP39 |
| Specifik rotation | +12,6 ° til +14,0 ° |
| Identifikation | Infrarød absorption |
| pH | 7,0 - 8,5 |
| SO4 | <=0,03 % |
| Fe | <=30 ppm |
| Tab ved tørring | <=0,2 % |
| Restprodukt ved antænding | <=0,1 % |
| Cl | <=0,05 % |
| Tungmetaller (PB) | <=15 sider/min |
| Relaterede forbindelser | Der findes ikke mere end 0,5 % af enhver individuel urenhed;Der findes ikke mere end 2,0 % af de samlede urenheder |
de quadruplex-dannende G-rige sekvenser er ujævnt fordelt i hele det menneskelige genom.Deres berigelse i onkogene promotorer og telomerer har skabt interesse for at målrette G-quadruplex (GQ) til en anticancerterapi.Her præsenterer vi en kvantitativ analyse af konformationerne og dynamikken af GQ-dannende sekvenser målt ved enkelt molekyle fluorescens.Derudover relaterer vi disse egenskaber til GQ-målretningsligander og G4 resolvase 1 (G4R1) proteinbinding.Vores resultat viser, at både loop (ikke-G-komponenter) længde og sekvens bidrager til konformationen af GQ.Spor af enkeltmolekyler i realtid afslører, at foldningsdynamikken også afhænger af løkkesammensætningen.Vi demonstrerer, at GQ-stabiliserende små molekyler, N-methyl mesoporphyrin IX (NMM), dets analog, NMP og G4R1-proteinet binder selektivt til den parallelle GQ-konformation.Vores resultater peger på kompleksiteten af GQ-foldning styret af looplængden og sekvensen, og hvordan GQ-konformationen bestemmer det lille molekyle og proteinbindingstilbøjeligheden.