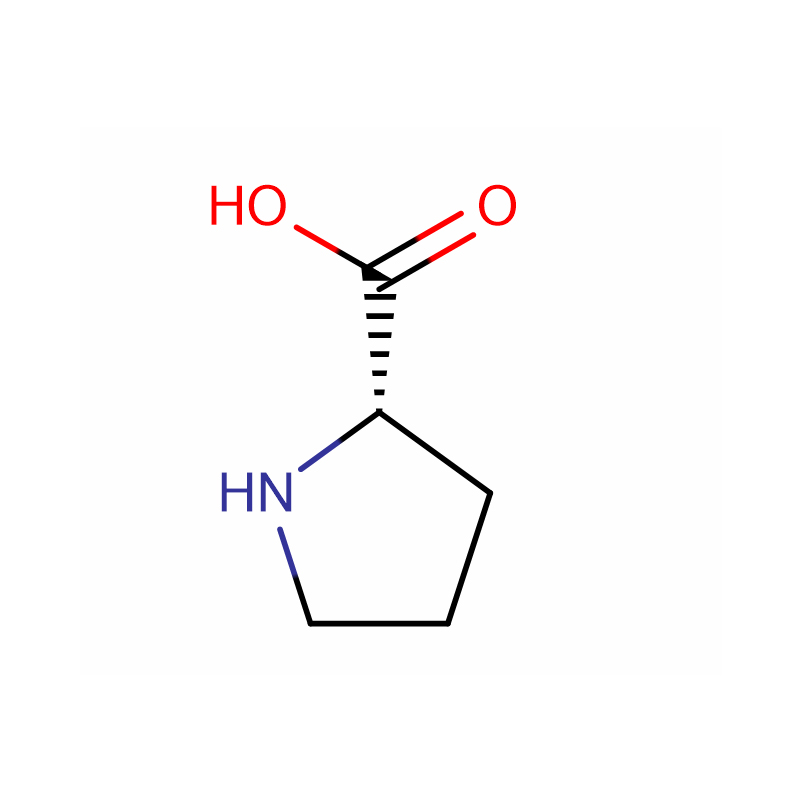
L-Proline Cas: 147-85-3 99% Hvidt pulver
| Katalognummer | XD90293 |
| produktnavn | L-Proline |
| CAS | 147-85-3 |
| Molekylær formel | C5H9NO2 |
| Molekylær vægt | 115.13046 |
| Opbevaringsdetaljer | Ambient |
| Harmoniseret tarifkode | 29339980 |
Produkt specifikation
| Assay | 99 % min |
| Udseende | Hvidt pulver |
| Specifik rotation | -84,5 til -86 |
| Tungmetaller | <15 ppm |
| AS | <1 ppm |
| Ph | 5,9 - 6,9 |
| SO4 | <0,050 % |
| Fe | <30 ppm |
| Tab ved tørring | <0,3 % |
| Restprodukt ved antænding | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,050 % |
| Løsningstilstand | >98 % |
At forstå metabolismen af den mikrobielle vært er afgørende for udvikling og optimering af helcellebaserede biokatalytiske processer, da det dikterer produktionseffektivitet.Dette gælder især for redoxbiokatalyse, hvor metabolisk aktive celler anvendes på grund af den regenerative cofaktor/cosubstrat-kapacitet, der er endogene i værten.Rekombinant Escherichia coli blev anvendt til overproduktion af prolin-4-hydroxylase (P4H), en dioxygenase, der katalyserer hydroxyleringen af frit L-prolin til trans-4-hydroxy-L-prolin med a-ketoglutarat (a-KG) som cosubstrat.I denne helcellebiokatalysator giver central kulstofmetabolisme det nødvendige cosubstrat a-KG, der kobler P4H biokatalytisk ydeevne direkte til kulstofmetabolisme og metabolisk aktivitet.Ved at anvende både eksperimentelle og beregningsbiologiske værktøjer, såsom metabolisk teknik og (13)C-metabolisk fluxanalyse ((13)C-MFA), undersøgte og beskrev vi kvantitativt den fysiologiske, metaboliske og bioenergetiske respons af helcellebiokatalysatoren til den målrettede biokonvertering og identificerede mulige metaboliske flaskehalse for yderligere rationel pathway engineering. En prolin-nedbrydningsdeficient E. coli-stamme blev konstrueret ved at slette putA-genet, der koder for proline-dehydrogenase.Helcellebiotransformationer med denne mutantstamme førte ikke kun til kvantitativ prolinhydroxylering, men også til en fordobling af den specifikke trans-4-L-hydroxyprolin (hyp) dannelseshastighed sammenlignet med vildtypen.Analyse af kulstofflux gennem central metabolisme af mutantstammen afslørede, at den øgede a-KG-efterspørgsel efter P4H-aktivitet ikke øgede den a-KG-genererende flux, hvilket indikerer en stramt reguleret TCA-cyklusoperation under de undersøgte betingelser.I vildtype-stammen forårsagede P4H-syntese og -katalyse en reduktion i biomasseudbytte.Interessant nok kompenserede ΔputA-stammen yderligere det associerede ATP- og NADH-tab ved at reducere vedligeholdelsesenergibehovet ved sammenligneligt lave glukoseoptagelseshastigheder i stedet for at øge TCA-aktiviteten. PutA-knockouten i rekombinant E. coli BL21(DE3)(pLysS) viste sig at være lovende for produktiv P4H-katalyse, ikke kun med hensyn til biotransformationsudbytte, men også med hensyn til hastighederne for biotransformation og prolinoptagelse og udbyttet af hyp på energikilden.Resultaterne indikerer, at ved en putA-knockout bliver koblingen af TCA-cyklussen til prolin-hydroxylering via cosubstratet a-KG en nøglefaktor, der begrænser og et mål for yderligere at forbedre effektiviteten af a-KG-afhængige biotransformationer.