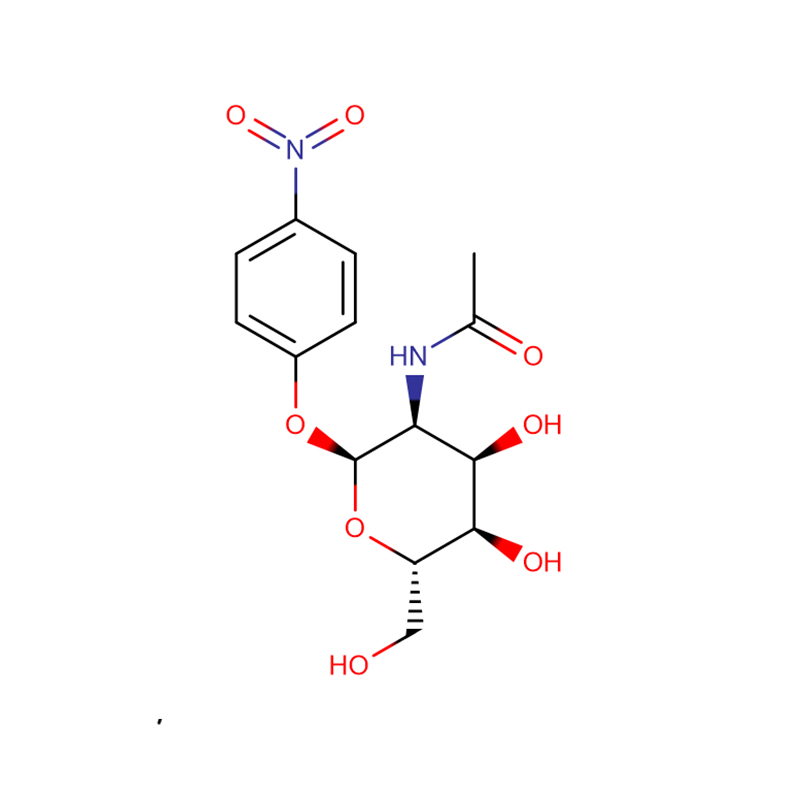
p-Nitrophenyl-aL-Fucopyranoside Cas:10231-84-2 Hvidt til bleggult krystallinsk pulver
| Katalognummer | XD90142 |
| produktnavn | p-Nitrophenyl-aL-Fucopyranosid |
| CAS | 10231-84-2 |
| Molekylær formel | C12H15NO7 |
| Molekylær vægt | 285,25 |
| Opbevaringsdetaljer | 2 til 8 °C |
| Harmoniseret tarifkode | 29400000 |
Produkt specifikation
| Udseende | Hvidt til bleggult krystallinsk pulver |
| Assay | 99 % |
| TLC | Enkelt sted |
| Renhed HPLC | Min. 98 % |
| Opløselighed (1 % i vand) | Klar farveløs opløsning |
| Massefylde | 1,503±0,06 g/cm3 (20 ºC 760 Torr), |
| Smeltepunkt | 196-197 ºC |
| Kogepunkt | 515,4°Cat760mmHg |
| Flammepunkt | 265,5°C |
| Brydningsindeks | 1,623 |
LecA (PA-IL) er et cytotoksisk lektin og adhæsin produceret af Pseudomonas aeruginosa, som binder hydrofobe galactosider med høj specificitet og affinitet.Ved at bruge en lecA-egfp translationsfusion og immunoblotanalyse af den ekstracellulære biofilmmatrix viser vi, at lecA udtrykkes i biofilm-dyrkede celler.I statiske biofilmassays på både polystyren og rustfrit stål blev biofilmdybde og overfladedækning reduceret ved mutation af lecA og forstærket i den LecA-overproducerende stamme PAO-P47.Biofilmoverfladedækning af forældrestammen, PAO-P47, men ikke lecA-mutanten på stålkuponer, blev også hæmmet af vækst i nærvær af enten isopropyl-beta-D-thiogalactosid (IPTG) eller p-nitrophenyl-alpha-D-galactosid ( NPG).Endvidere kunne modne vildtype-biofilm dannet i fravær af disse hydrofobe galactosider spredes ved tilsætning af IPTG.I modsætning hertil havde tilsætning af p-nitrophenyl-alpha-L-fucose (NPF), som har en høj affinitet for P. aeruginosa LecB (PA-IIL) lectin ingen effekt på biofilmdannelse eller spredning.Planktonisk vækst af P. aeruginosa PAO1 var upåvirket af tilstedeværelsen af IPTG, NPG eller NPF, og stammen var heller ikke i stand til at udnytte disse sukkerarter som kulstofkilder, hvilket tyder på, at de observerede effekter på biofilmdannelse skyldtes den kompetitive hæmning af LecA-ligand bindende.Lignende resultater blev også opnået for biofilm dyrket under dynamiske strømningsforhold på stålkuponer, hvilket tyder på, at LecA bidrager til P. aeruginosa biofilmarkitektur under forskellige miljøforhold.
En alfa-L-fucosidase (EC 3.2.1.51), der er i stand til at frigive t-fucosyl-resten fra sidekæden af xyloglucan-oligosaccharider, er blevet påvist i bladene af Arabidopsis-planter.Desuden blev en alfa-L-fucosidase med lignende substratspecificitet oprenset fra kålblade (Brassica oleracea) for at give et enkelt bånd på SDS-PAGE.To peptidsekvenser blev opnået fra dette proteinbånd, og de blev brugt til at identificere et Arabidopsis-gen, der koder for en alfa-fucosidase, som vi foreslår at kalde AtFXG1.Derudover er der også fundet et Arabidopsis-gen med homologi med kendte alfa-L-fucosidaser, og vi foreslog at navngive det som AtFUC1.Både AtFXG1 og ATFUC1 blev heterologt udtrykt i Pichia pastoris-celler og alfa-L-fucosidaseaktiviteterne udskilt til dyrkningsmediet.Alfa-L-fucosidasen kodet af AtFXG1 var aktiv mod oligosacchariderne fra xyloglucan XXFG såvel som mod 2'-fucosyl-lactitol, men ikke mod p-nitrophenyl-alpha-L-fucopyranosid.Imidlertid var det heterologt udtrykte AtFUC1 kun aktivt mod 2'-fucosyl-lactitol.Førstnævnte skal således være relateret til xyloglucan-metabolisme.