IPTG (isopropyl-β-D-thiogalactosid) er en analog af β-galactosidase-substrat, som er meget inducerbart.Under induktion af IPTG kan induceren danne et kompleks med repressorproteinet, således at konformationen af repressorproteinet ændres, så det ikke kan kombineres med målgenet, og målgenet udtrykkes effektivt.Så hvordan skal koncentrationen af IPTG bestemmes under forsøget?Er jo større jo bedre?
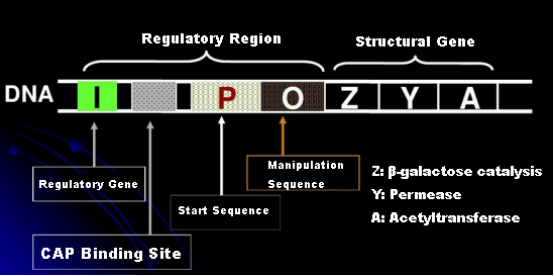
Lad os først forstå princippet om IPTG-induktion: E. colis lactose-operon (element) indeholder tre strukturelle gener, Z, Y og A, som koder for henholdsvis β-galactosidase, permease og acetyltransferase.lacZ hydrolyserer lactose til glucose og galactose eller til allo-lactose;lacY tillader laktose i miljøet at passere gennem cellemembranen og trænger ind i cellen;lacA overfører acetylgruppen fra acetyl-CoA til β-galactosid, hvilket involverer fjernelse af toksisk effekt.Derudover er der en operationssekvens O, en startsekvens P og et regulatorisk gen I. I-genkoden er et repressorprotein, der kan binde sig til positionen O i operatorsekvensen, således at operonet (meta) undertrykkes og slukket.Der er også et bindingssted for katabolisk genaktivatorprotein-CAP-bindingssted opstrøms for den initierende sekvens P. P-sekvensen, O-sekvensen og CAP-bindingsstedet udgør tilsammen den regulatoriske region af lac-operonen.De kodende gener for de tre enzymer reguleres af den samme regulatoriske region for at opnå den koordinerede ekspression af genprodukter.
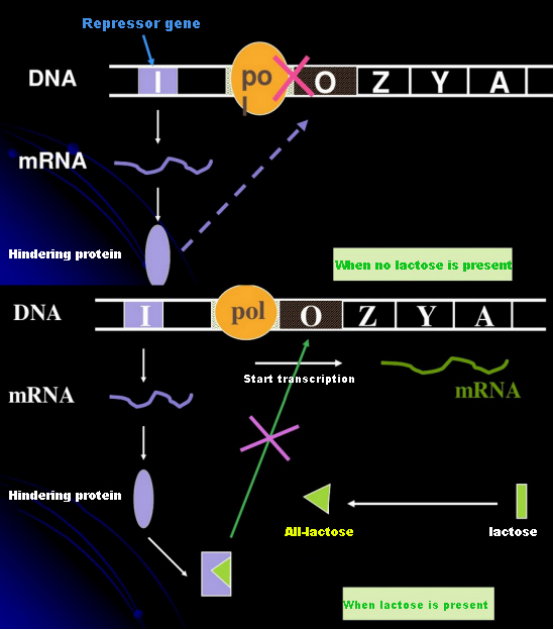
I mangel af laktose er lac-operonen (meta) i en tilstand af undertrykkelse.På dette tidspunkt binder lac-repressoren udtrykt af I-sekvensen under kontrol af PI-promotorsekvensen til O-sekvensen, hvilket forhindrer RNA-polymerase i at binde til P-sekvensen og inhiberer transkriptionsinitiering;når laktose er til stede, kan lac operon (meta) induceres. I dette operon (meta) system er den egentlige inducer ikke selve laktose.Lactose kommer ind i cellen og katalyseres af β-galactosidase for at blive omdannet til allolactose.Sidstnævnte, som et inducermolekyle, binder sig til repressorproteinet og ændrer proteinkonformationen, hvilket fører til dissociationen af repressorproteinet fra O-sekvensen og transkription.Isopropylthiogalactosid (IPTG) har samme effekt som allolactose.Det er en meget kraftig inducer, som ikke metaboliseres af bakterier og er meget stabil, så den bruges meget i laboratorier.
Hvordan bestemmes den optimale koncentration af IPTG?Tag E. coli som eksempel.
Den gensplejsede E. coli BL21-stamme indeholdende den positive rekombinante pGEX (CGRP/msCT) blev inokuleret i LB flydende medium indeholdende 50 μg·mL-1 Amp og dyrket natten over ved 37°C.Ovenstående kultur blev inokuleret i 10 flasker 50mL frisk LB flydende medium indeholdende 50μg·mL-1 Amp i et forhold på 1:100 for ekspansionskultur, og når OD600 værdien var 0,6~0,8, blev IPTG tilsat til slutkoncentrationen.Det er 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Efter induktion ved samme temperatur og samme tid blev 1 ml af bakterieopløsningen taget fra den, og bakteriecellerne blev opsamlet ved centrifugering og underkastet SDS-PAGE for at analysere indflydelsen af forskellige IPTG-koncentrationer på proteinekspression, og derefter vælg IPTG-koncentrationen med den største proteinekspression.
Efter forsøg vil det vise sig, at koncentrationen af IPTG ikke er så stor som muligt.Dette skyldes, at IPTG har en vis toksicitet over for bakterier.Overskridelse af koncentrationen vil også dræbe cellen;og generelt håber vi, at jo mere opløseligt protein der udtrykkes i cellen, jo bedre, men i mange tilfælde, når koncentrationen af IPTG er for høj, vil der blive dannet en stor mængde inklusion.Krop, men mængden af opløseligt protein faldt.Derfor er den bedst egnede IPTG-koncentration ofte ikke jo større, jo bedre, men jo lavere koncentration.
Formålet med induktion og dyrkning af gensplejsede stammer er at øge udbyttet af målproteinet og reducere omkostningerne.Ekspressionen af målgenet påvirkes ikke kun af stammens egne faktorer og ekspressionsplasmidet, men også af andre eksterne forhold, såsom koncentrationen af induceren, induktionstemperaturen og induktionstiden.Derfor er det generelt, før et ukendt protein udtrykkes og oprenses, bedst at studere induktionstid, temperatur og IPTG-koncentration for at vælge de passende betingelser og opnå de bedste eksperimentelle resultater.
Indlægstid: 31. december 2021

