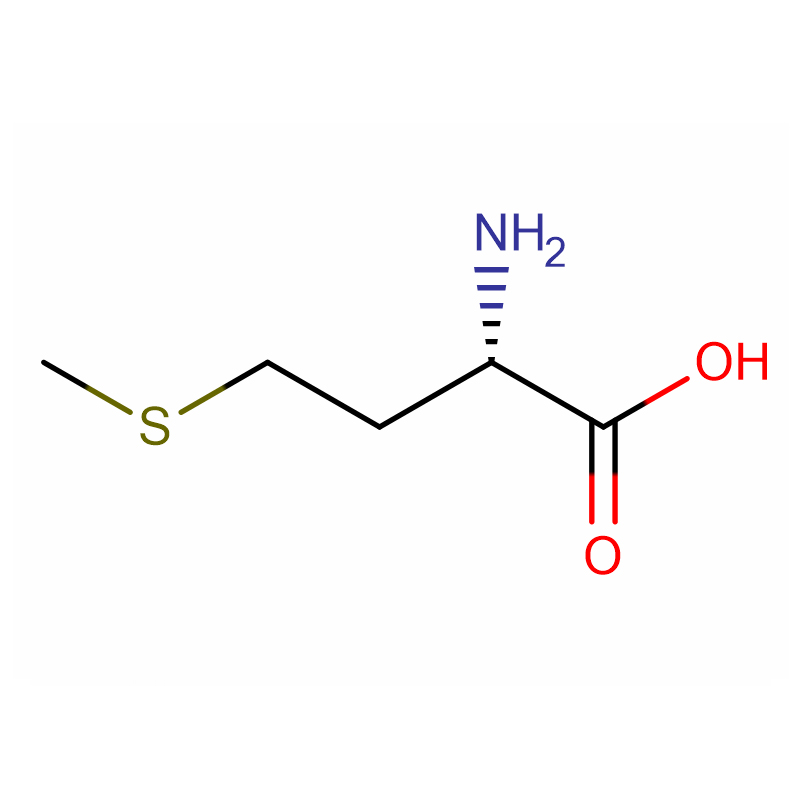
L-Methionin Cas: 63-68-3 99% Hvidt krystallinsk pulver
| Katalognummer | XD90287 |
| produktnavn | L-methionin |
| CAS | 63-68-3 |
| Molekylær formel | C5H11NO2S |
| Molekylær vægt | 149,21134 |
| Opbevaringsdetaljer | Ambient |
| Harmoniseret tarifkode | 29304010 |
Produkt specifikation
| Assay | 98 % - 101,5 % |
| Udseende | Hvide krystaller eller krystallinsk pulver |
| Konklusion | |
| Identifikation | Opfylder kravet |
| pH | 5,6 - 6,1 |
| Tab ved tørring | ≤ 0,3 % |
| Sulfat (SO4) | ≤ 0,03 % |
| Jern | ≤ 0,003 % |
| Restprodukt ved antænding | ≤ 0,4 % |
| Chlorid | ≤ 0,05 % |
| Tung metal | ≤ 0,0015 % |
| Kromotograisk renhed | Der findes ikke mere end 2,0 % af de samlede urenheder |
| Specifik rotation [ α ] D 2 5 | +22,4º ~ +24,7º |
Vores tidligere undersøgelser har afsløret dets afgørende roller i både tidlige og sene stadier af KSHV-infektion.I denne undersøgelse undersøgte vi interaktomet af ORF45 ved hjælp af et panel af monoklonale antistoffer.Ud over de tidligere identificerede ekstracellulære regulerede kinase (ERK) og p90 ribosomale S6 kinase (RSK) proteiner, fandt vi adskillige andre co-oprensede proteiner, herunder fremtrædende på ~38 kDa og ~130 kDa.Massespektrometri afslørede, at 38-kDa-proteinet er viralt ORF33, og 130-kDa-proteinet er cellulært USP7 (ubiquitin-specifik protease 7).Vi kortlagde det ORF33-bindende domæne til de stærkt konserverede carboxylterminale 19 aminosyrer (aa) af ORF45 og det USP7-bindende domæne til det rapporterede konsensusmotiv i den centrale region af ORF45.Ved hjælp af immunfluorescensfarvning observerede vi kolokalisering af ORF45 med ORF33 eller USP7 både under transficerede betingelser og i KSHV-inficerede celler.Desuden bemærkede vi ORF45-afhængig relokalisering af en del af ORF33/USP7 fra kernen til cytoplasmaet.Vi fandt, at ORF45 forårsagede en stigning i ORF33-proteinakkumulering, der blev afskaffet, hvis enten det ORF33- eller USP7-bindende domæne i ORF45 blev slettet.Endvidere reducerede deletion af den konserverede carboxylterminal af ORF45 i KSHV-genomet drastisk niveauet af ORF33-protein i KSHV-inficerede celler og ophævede produktionen af afkomsvirioner.Samlet afslører vores resultater ikke kun nye komponenter i ORF45-interaktomet, men demonstrerer også, at interaktionerne mellem disse proteiner er afgørende for KSHV-lytisk replikation. Kaposi's sarkom-associerede herpesvirus (KSHV) er årsagen til adskillige humane kræftformer.KSHV ORF45 er et multifunktionelt protein, der kræves til KSHV lytisk replikation, men de nøjagtige mekanismer, hvormed ORF45 udfører sine kritiske funktioner, er uklare.Vores tidligere undersøgelser afslørede, at alt ORF45-protein i celler eksisterer i komplekser med høj molekylvægt.Vi søgte derfor at karakterisere interaktomet af ORF45 for at give indsigt i dets roller under lytisk replikation.Ved hjælp af et panel af monoklonale antistoffer undersøgte vi ORF45-interaktomet i KSHV-inficerede celler.Vi identificerede to nye bindingspartnere til ORF45: det virale protein ORF33 og cellulær ubiquitin-specifik protease 7 (USP7).Vi demonstrerer yderligere, at interaktionen mellem ORF45 og ORF33 er afgørende for den effektive produktion af KSHV-viruspartikler, hvilket tyder på, at den målrettede interferens med denne interaktion kan repræsentere en ny strategi til at hæmme KSHV-lytisk replikation.