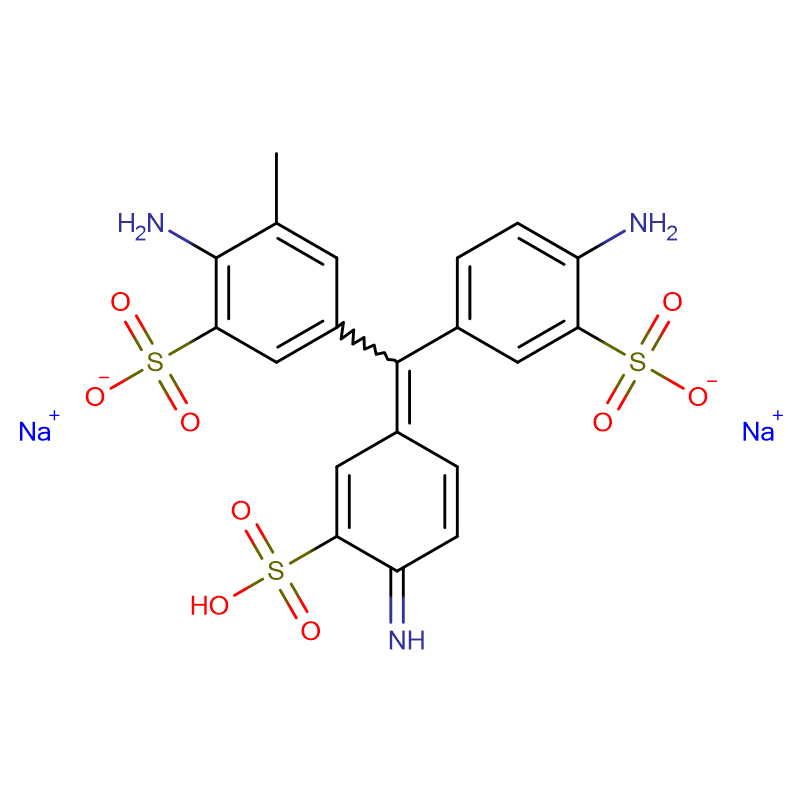
Fuchsinsyre CAS:3244-88-0
| Katalognummer | XD90488 |
| produktnavn | Fuchsin syre |
| CAS | 3244-88-0 |
| Molekylær formel | C20H20N2O9S3 |
| Molekylær vægt | 585.5382 |
| Opbevaringsdetaljer | Ambient |
| Harmoniseret tarifkode | 32129000 |
Produkt specifikation
| Udseende | mørkegrønt krystallinsk pulver |
| Assay | 70 % |
| Vandindhold | 10,0 % maks |
| Opløselighed | Klar opløsning, ingen partikler |
| Styrke | 100 % min |
| Vand uopløselig | 0,2 % maks |
Ø-amyloidpolypeptid (IAPP; også kendt som amylin) er ansvarlig for ø-amyloiddannelse ved type 2-diabetes, og IAPP-induceret toksicitet menes at bidrage til tabet af β-cellemasse forbundet med de sene stadier af type 2-diabetes.Ø-amyloiddannelse kan også spille en rolle ved transplantationsfejl efter transplantation.IAPP produceres som et prohormon, pro-ø-amyloid-polypeptid (proIAPP), og behandles i de sekretoriske granula i pancreas-β-cellerne.Delvist forarbejdede former for proIAPP findes i amyloidaflejringer;mest bemærkelsesværdig er et mellemprodukt på 48 rester, proIAPP(1-48), som inkluderer den N-terminale pro-udvidelse, men som er blevet korrekt behandlet i C-terminalen.Ufuldstændig behandling kan spille en rolle i ø-amyloiddannelse ved at fremme interaktioner med sulfaterede proteoglycaner i den ekstracellulære matrix, som igen fremmer amyloiddannelse.Vi viser, at surt fuchsin (3-(1-(4-amino-3-methyl-5-sulfonatophenyl)-1-(4-amino-3-sulfonatophenyl)methylen)cyclohexa-1,4-diensulfonsyre), en simpel sulfoneret triphenylmethylderivat, er en potent hæmmer af amyloiddannelse af proIAPP(1-48)-mellemproduktet.Det mere komplicerede triphenylmethanderivat hurtigt grønne FCF {ethyl-[4-[[4-[ethyl-[(3-sulfophenyl)methyl]amino]phenyl]-(4-hydroxy-2-sulfophenyl)methyliden]-1-cyclohexa -2,5-dienyliden]-[(3-sulfophenyl)methyl]azanium} hæmmer også amyloiddannelse af IAPP og proIAPP-bearbejdningsmellemproduktet.Begge forbindelser inhiberer amyloiddannelse ved blandinger af proIAPP-mellemproduktet og modellen glycosaminoglycan-heparansulfat.Surt fuchsin hæmmer også glycosaminoglycan-medieret amyloiddannelse ved moden IAPP.Evnen til at inhibere amyloiddannelse skyldes ikke blot, at forbindelserne sulfoneres, eftersom den sulfonerede inhibitor af amyloid-β, tramiprosat, ikke er en inhibitor af amyloiddannelse ved proIAPP(1-48).